DESCRIPCION GENERAL:
1. Los 109 elementos reconocidos por la Unión Internacional de Química Pura y Aplicada (IUPAC) están ordenados según el numero atomico creciente, en 7 periodos y 16 grupos (8 grupos A y 8 grupos B). Siendo el primer elemento Hidrogeno (Z = 1) y el último reconocido hasta el momento meitnerio (Z = 109); pero se tienen sintetizados hasta el elemento 118.
2. Periodo, es el ordenamiento de los elementos en línea horizontal. Estos elementos difieren en propiedades, pero tienen la misma cantidad de niveles en su estructura atómica
3. Grupo o Familia, Es el ordenamiento de los elementos en columna. Estos elementos presentan similar disposición de sus electrones externos; de allí que forman familias de elementos con propiedades químicas similares.
Grupos “A”
Están formados por los elementos representativos donde los electrones externos o electrones de valencia estan en orbitales “s” y/o “p”; por lo tanto sus propiedades dependen de estos orbitales.
Grupos “B”
Están formados por elementos de transición, en cuyos átomos el electrón de mayor energía relativa están en orbitales “d” o “f”; y sus electrones de valencia se encuentran en orbitales “s” (del último nivel) y/o orbitales “d” o “f”; por lo tanto sus propiedades químicas dependen de estos orbitales.
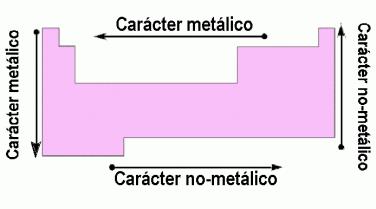
Se denominan elementos de transición, porque se consideran como tránsito entre elementos metálicos de alta reactividad que forman generalmente bases fuertes (IA y IIA) y los elementos de menor carácter metálico que poseen más acentuado su tendencia a formar ácidos (IIIA, IVA, … VIIA).
El grupo VIIIB abarca tres columnas (familia del Fe, Co y Ni). Los elementos del grupo IB (Cu, Ag, Au), así como también los elementos del grupo VIB (Cr y Mo) no cumplen la distribución electrónica, como ya se analizará oportunamente.
Los elementos del mismo grupo generalmente difieren en sus propiedades. Los elementos de transición interna (tierras raras), poseen electrones de mayor energía relativa en orbitales “f” y pertenecen al grupo IIIB; a estos se les denomina lantánidos y actínidos, cuya abundancia en la naturaleza es muy escasa y muchas veces solo se encuentran en forma de trazas combinados con otros elementos, razón por lo cual se llama “tierras raras”.
Lantánidos (lantanoides): comienza con lantano (Z=57) y termina en lutecio (Z=71), poseen propiedades semejantes al lantano.
Actínidos (actinoides): comienza con el actinio (Z=87) y termina con lawrencio (Z=103), poseen propiedades semejantes al actinio